A PRUEBA!!!
Propiedades de los estados físicos
Las propiedades son las características o cualidades que nos permiten clasificar los objetos y que determinan sus usos.
Los sonidos,olores,texturas,los olores y sabores,junto con los estados de agregación de la materia forman las propiedades cualitativas.
Los 5 sabores que detectamos con el gusto son el salado,dulce,ácido,amargo y umami.
Las propiedades cualitativas no se pueden medir,pero dependen de la agudeza de los sentidos.
La materia en la naturaleza se puede encontrar en sólidos (rocas,madera o los huesos); Líquido (agua,gasolina,aceite y las lágrimas) y gaseoso como el aire,además puede estar en forma de plasma(las estrellas) a dichos estados se les conoce como estados de agregación y dependen de la organización de sus partículas.
Un fluido no newtoniano es un fluido cuya viscosidad varía de la temperatura y la tensión o fuerza que se le aplica.
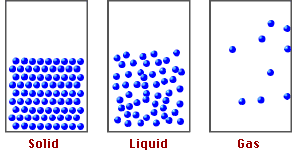
El modelo corpuscular establece que toda la materia está formada por partículas en constante movimiento separadas entre sí,en el estado sólido las partículas se encuentran muy cerca una de otras;líquidos están muy separados y en el gaseoso están aún más apartadas.
Algunos materiales como el malvavisco,tiene características de dos estados de agregación,por lo que su clasificación no resulta obvia.
Características cualitativas de los estados físicos.
Modelo cinético corpuscular (en forma de partículas), a los tres estados de agregación de la materia.
PROPIEDADES EXTENSIVAS E INTENSIVAS DE LA MATERIA.
Prefijos, múltiplos y submúltiplos del Sistema Internacional de Unidades


Comentarios
Publicar un comentario